Exploration non invasive
Imagerie par résonance magnétique
(IRM)
L’imagerie par résonance magnétique offre une excellente résolution spatiale (50 – 200 μm) et permet d’obtenir des images anatomiques de très haute qualité pour la visualisation des différentes régions sur des organes fixes ou mobiles (avec synchronisation des acquisitions au rythme respiratoire et/ou cardiaque). De plus, il existe une grande diversité de méthodes qui permettent une large exploration fonctionnelle.
L’IRM
au sein du CREFRE
Cette technologie repose sur le phénomène de résonance magnétique nucléaire. Le noyau le plus accessible est l’hydrogène essentiellement présent sous forme d’eau dans les organismes vivants. Le signal produit durant le phénomène de résonance de l’hydrogène est conditionné par l’application d’une séquence spécifique au protocole expérimental choisi. Cette séquence combine une succession d’impulsions radiofréquence et de gradients de champ magnétique afin d’obtenir une image ou un spectre caractéristique du paramètre fonctionnel choisi de la zone d’intérêt étudiée. Cette capacité plurimodale de l’IRM combinée à des conditions d’acquisitions multiparamétriques (choix des antennes, mobilité de l’organe, capacité de synchronisation, zone d’intérêt) implique un compromis systématique entre résolution spatiale, temps d’acquisition, et choix des séquences.
Les prestations IRM/SRM sont généralement prises en charge par le service ENI. Il peut s’agir de prestations de service (l’utilisateur défini lui-même le protocole/séquences à mettre en œuvre), de prestations de recherche (le personnel du service propose un protocole / des séquences qui seront mise en œuvre après validation par le demandeur) ou de collaborations scientifiques (développement / validation de séquences spécifiques au projet).
Des formations pour mise en autonomie pourront être proposées aux utilisateurs volontaires dont le volume d’utilisation de l’IRM pourrait le justifier.
Logiciel d’acquisition et d’analyse ParaVision6 Bruker (IRM/SRM) ou logiciel d’analyse en open source MRIcroGL et MRIcron
La prise en charge
et manipulation des animaux
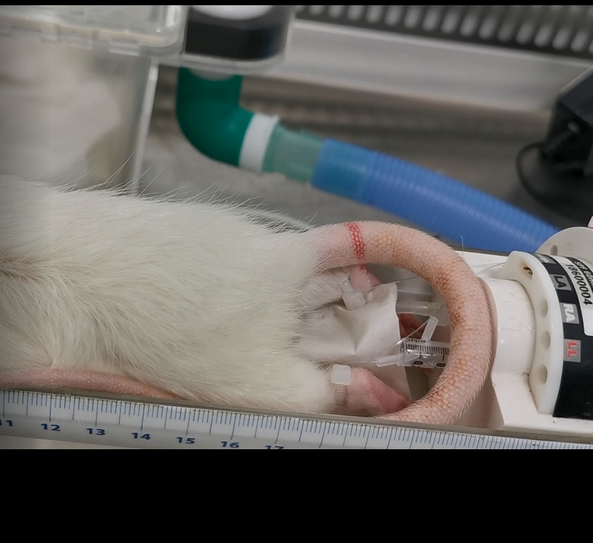
Le service ENI du CREFRE est le premier service français ayant développé les outils et méthodes permettant le maintien du statut sanitaire des animaux pour les acquisitions IRM . Ainsi, de la réception à sa restitution toutes les manipulations des cages et animaux sont réalisées sous un poste de sécurité microbiologique. Des cellules d’imagerie sont utilisées pour isoler l’animal du milieu extérieur tout en conservant la qualité des images acquises. Ces cellules d’imagerie permettent le maintien de l’anesthésie gazeuse, la surveillance de la fréquence respiratoire et/ou cardiaque, de la température corporelle et l’administration de substances pendant les acquisitions. Une filtration de type Hepa est utilisée pour assurer le confinement biologique à l’intérieur de la cellule.
Différentes combinaisons d’équipements et accessoires sont possibles (4 cellules de confinement assurant le maintien en température et avec monitoring (ECG, respiration, température), 4 antennes réceptrices, et 3 résonateurs). Les animaux sont maintenus sous anesthésie pour tous les protocoles (par injection et/ou inhalation).
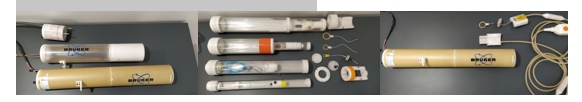
Résonateur 40, 60, 72 mm – Cellules et antennes réceptrices

Résonateur 40, 60, 72 mm – Cellules et antennes réceptrices
L’IRM est pourvue d’une large palette de séquences que nous avons optimisées pour différents protocoles. Par ailleurs, nous avons obtenus par collaboration plusieurs fichiers de séquences qui font l’objet d’un engagement de citation (coll I2MC/CREFRE et Marseille, CRMBM, F.Kober (pour myocardial ASL) ; coll ToNIC et Grenoble, GIN, E. Barbier (pour perfusion cérébrale pCASL) ; Coll ToNIC et Bordeaux, RMSB, A. Trotier, (pour map T1 rapide, MP2RAGE)).
Certains protocoles expérimentaux peuvent être multimodaux (quantitatifs) avec combinaison des données obtenues nécessitant un pipeline de post-traitement de plusieurs images (ex : mesure de la consommation locale en oxygène cérébral (CMRO2) qui nécessite 5 images obtenues par 4 méthodes T2-W, map-T2, map-T2* et pCASL). Le service dispose de l’ensemble des outils logiciels pour le traitement des images (station dédiée).
Ce catalogue n’est pas exhaustif, n’hésitez pas à contacter le service pour définir les possibilités méthodologiques qui pourraient alimenter votre projet expérimental
IRM
anatomique
Neurologie
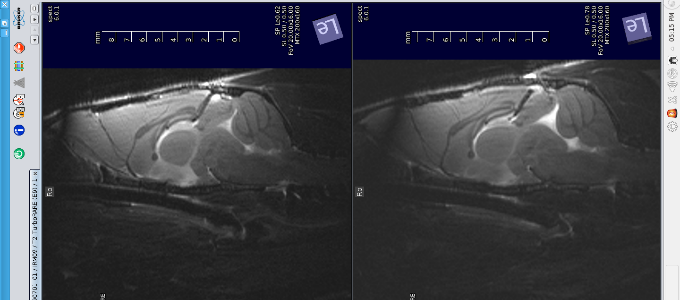
T2-W coupe sagittale cerveau souris (modification volume des ventricules).
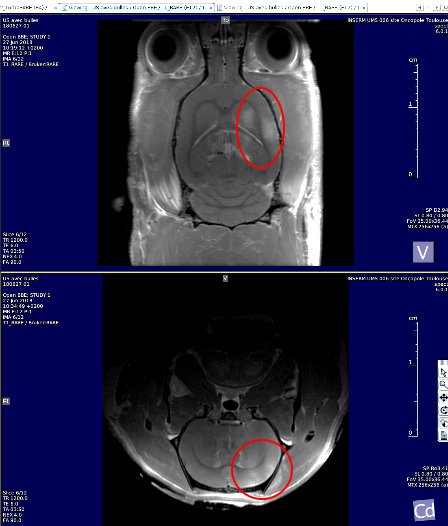
Rupture de la barrière hémato-encéphalique (BHE). Visualisation après injection d’un agent de contraste au Gadolinium (Dotarem)A gauche T1-W ouverture localisée méthode ultrasons combinée à l’injection de µbulles chez le rat (collaboration ToNIC/CREFRE)
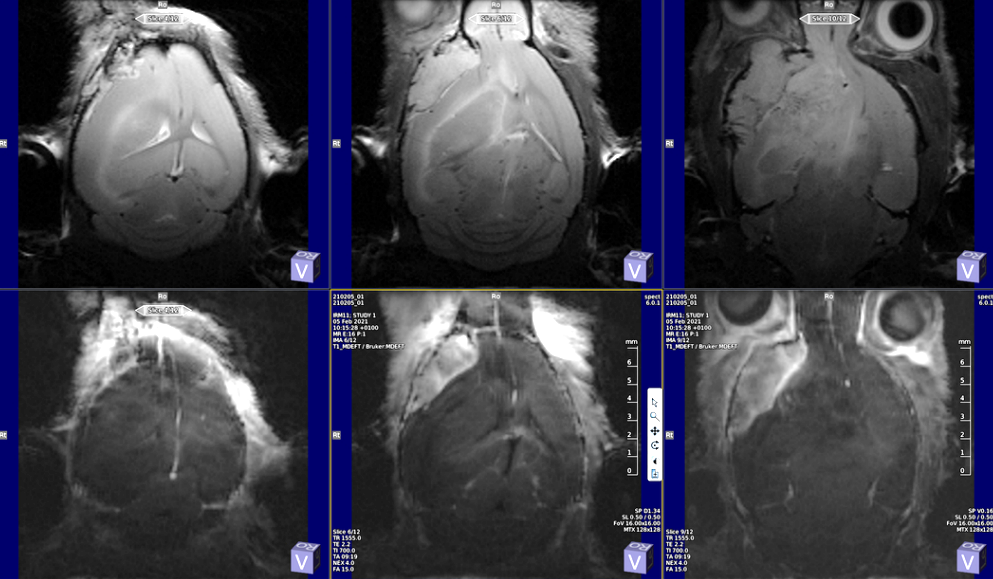
Tumeur extra-axiale souris T2-W (haut) T1-W post gado (bas).
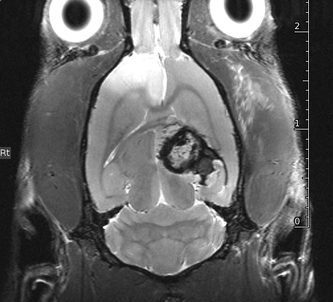
T2-W Tête de rat quantification de volumes lésionnels.
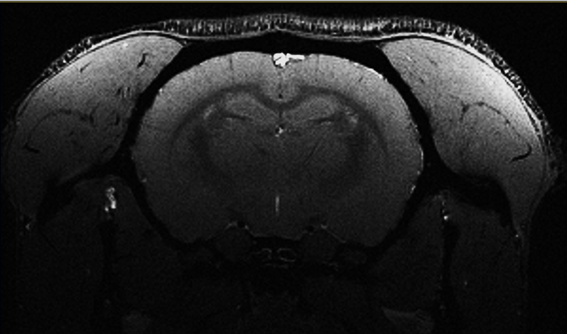
Acquisition avec rehaussement de la susceptibilité SWI
Coupe coronale rat. Visualisation des perforantes.
Cardiologie
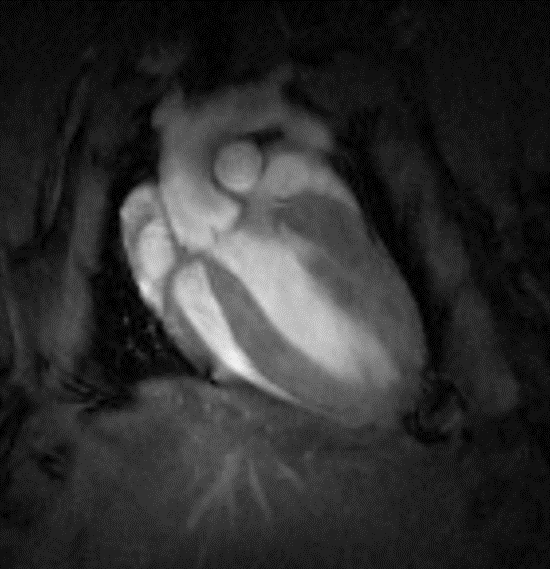
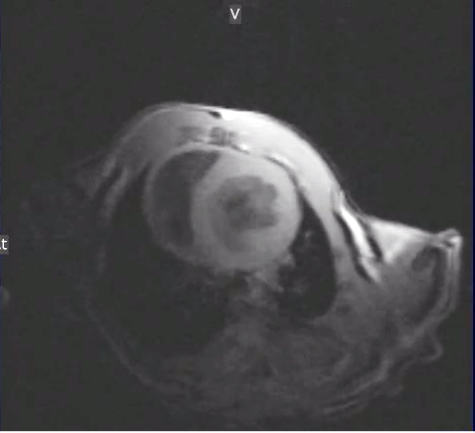
Cine-Flash T2* Coupe grand axe 4 chambres cœur et petit axe de souris synchronisation avec signal EC
Autres organes
Pancréas (souris)
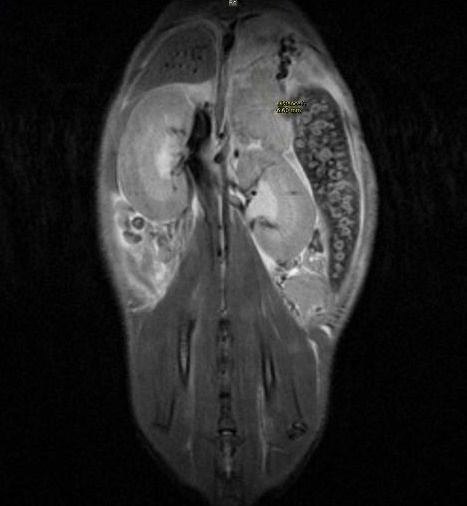
T2-W synchro rythme respiratoire
Tumeur Pancréas souris
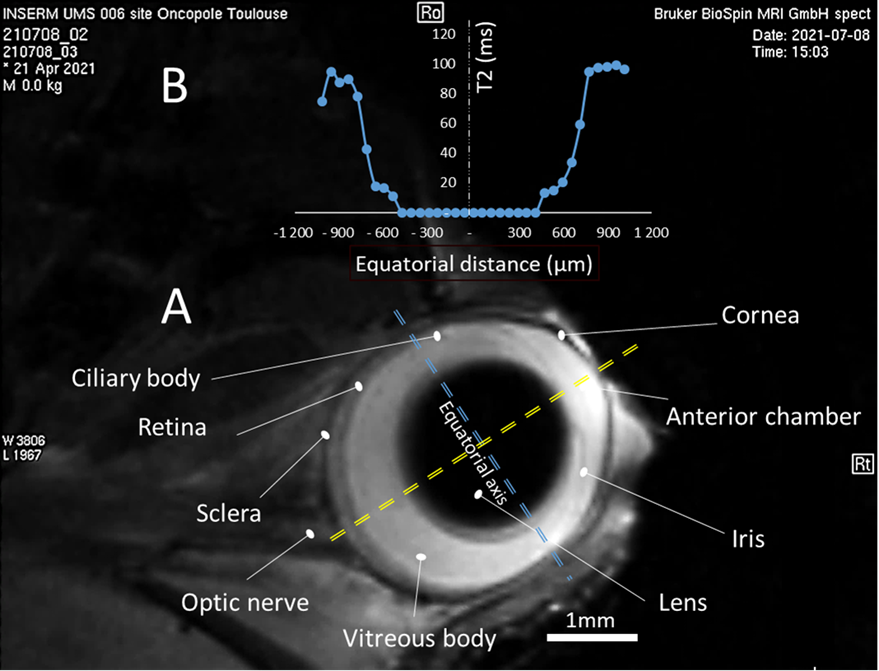
Œil de souris (T2-W 60µm 6 min)
Angiographie
(sans agent de contraste)
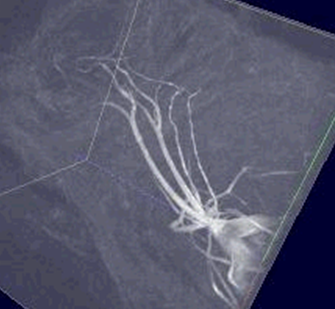
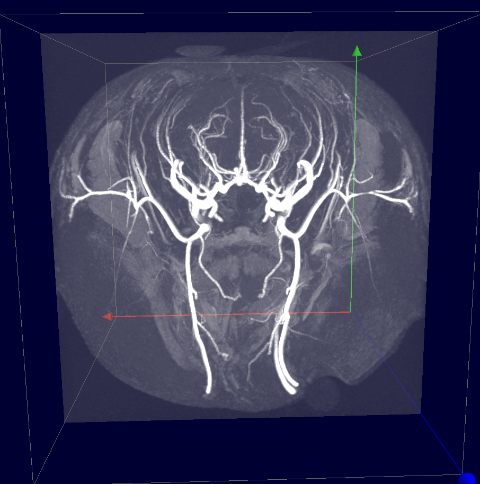
Arc aortique et artères supraaortiques souris (gauche), réseau artériel tête rat (droite) avec la méthode temps de vol (TOF) utilisée pour l’analyse du réseau vasculaire (projet Hanuman sur le marmouset) et pour le repérage anatomique des coupes de mesures des flux vasculaires.
IRM
fonctionnelle
Obtention d’images quantitatives de perfusion, flux, diffusion et de relaxométrie.
Perfusion
Neurologie
Avec injection de produit de contraste DSC
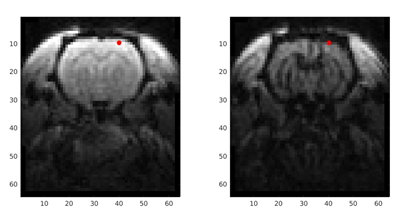
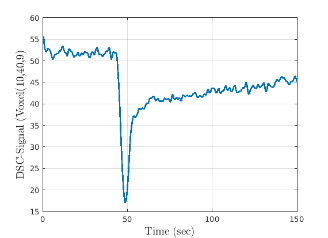
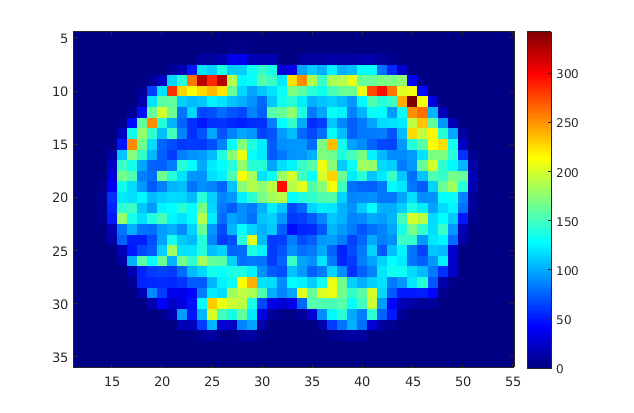
Acquisition dynamique 2s/image avant injection (A) et pendant le passage (B) de l’agent de contraste, profil dynamique d’un voxel (C) permettant le calcul d’une carte de perfusion D (environ 200 ml/100g/min au niveau du cortex).
Sans produit de contraste ASL (marquage de spin artériel)
Inversion globale du volume sanguin circulant séquence FAIR
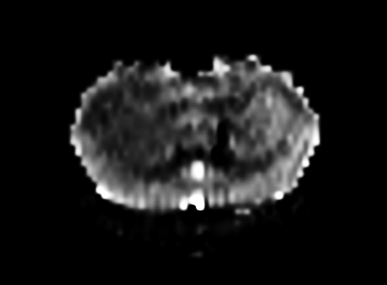
Modèle cerveau de souris avec tumeur et hypoperfusion localisée dans l’hémisphère droit (100 vs 150 ml/100g/min)
Inversion avec impulsion adiabatique au niveau des carotides communes (pCASL)
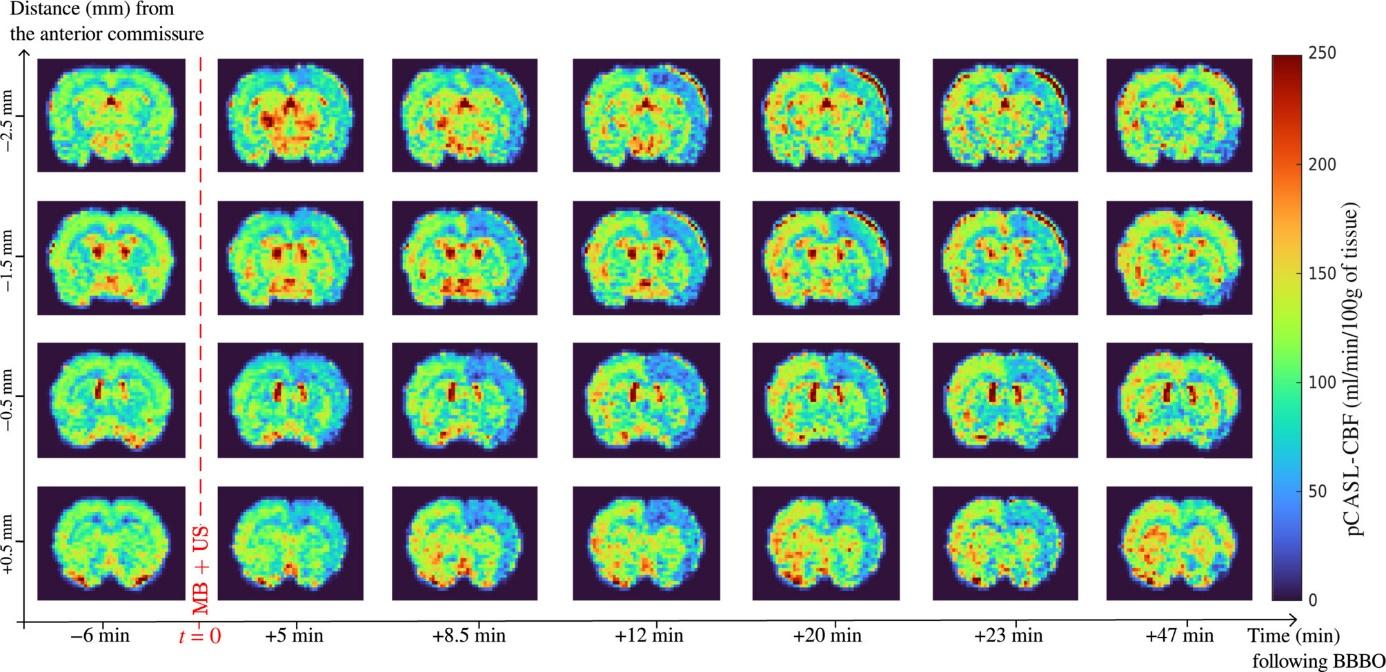
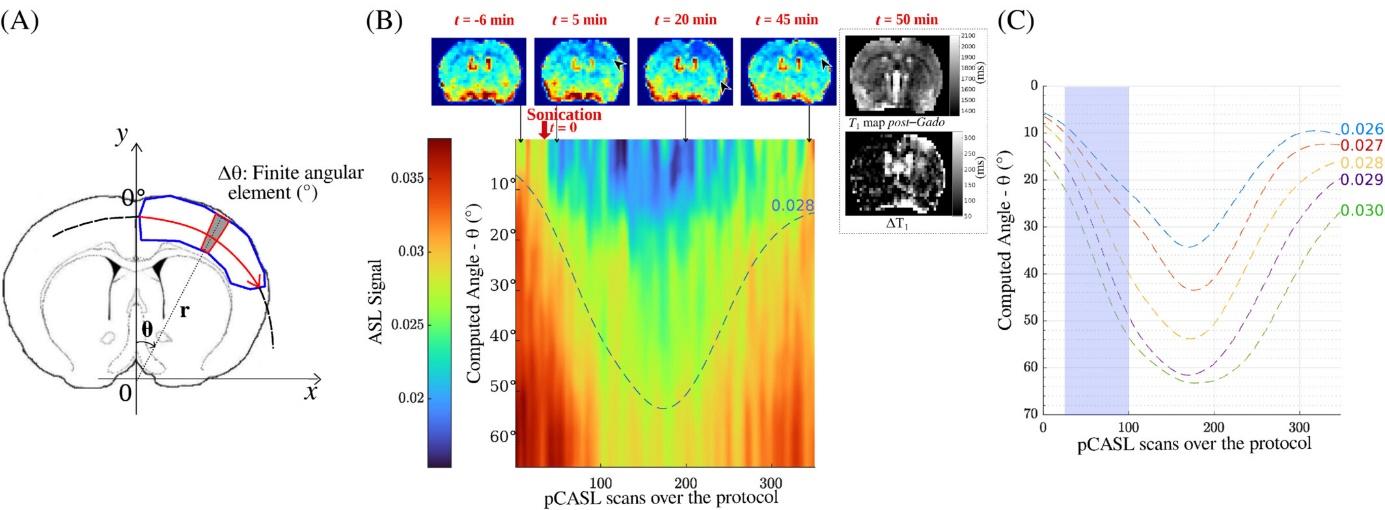
Mesure dynamique de la perfusion cérébrale combinée à l’ouverture de la BHE chez le rat (Labriji W. et al. Magnetic Resonance in Medecine , 89,6,2281-2294)
Flux
Neurovasculaire:
Liquide Cérébrospinal LCS :


Couronne du LCS entourant la moelle épinière visible au niveau de C1-C2 chez le rat (intérieur du cercle rouge, flux oscillant du LCS durant le cycle cardiaque Vmax 2cm/s).
Cardiologie
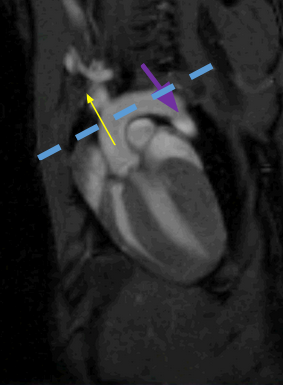
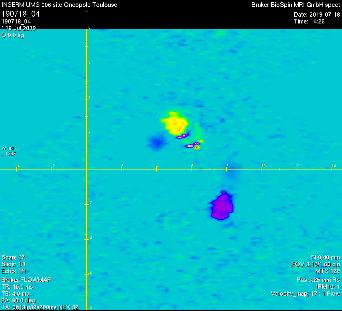
Mesure dynamique synchronisé à l’ECG du flux aortique montant et descendant chez la souris (12 images /cycle cardiaque, fréquence cardiaque de la souris 300 bts/min)
Image colorisée segment du cycle avec (Vmax 60cm/s) et descendante (Vmax -50cm/s)
Mesure de flux dans les milieux microporeux

Étude des propriétés de transport de milieux microporeux biomimétiques
Simulation dans un capillaire 280 µm et un très faible débit limite de détection de la vitesse 2 mm/s
Diffusion, ADC, DTI

Architecture substance blanche cérébrale
Image reconstruite à partir de l’acquisition DTI (36 directions sur cerveau de rat, b = 650 mm2/s) avec codage couleur des orientations de diffusion privilégiées
Cartes de relaxométrie
Map T2, map T2*, map T1
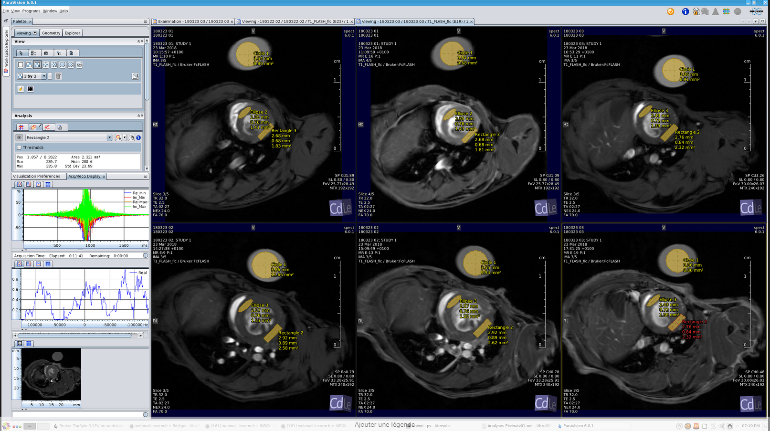
cardiologie
Etude de la modification de T1 cœur de souris avec restriction aortique (œdème potentiel) en systole (haut) et diastole (bas). Mesure saturation T1 dépendante en fonction de l’angle d’impulsion en présence d’une référence externe
Neurologie
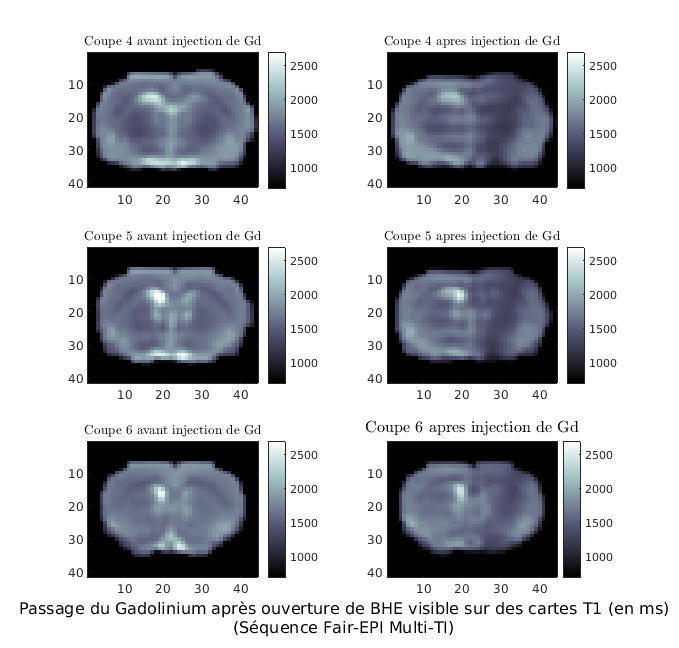
map T1 en post-traitement d’acquisition réalisées avec la séquence MPRAGE (coll Bordeaux RMSB) permettant une acquisition 3D rapide.
Présentation de coupes obtenues sur le rat (3D 7 min) avant (gauche) et après administration de Gd (droite) dans un contexte d’ouverture de la BHE (infiltration de Gd diminution du T1)
Caractérisation d’agents de contraste IRM et multimodaux
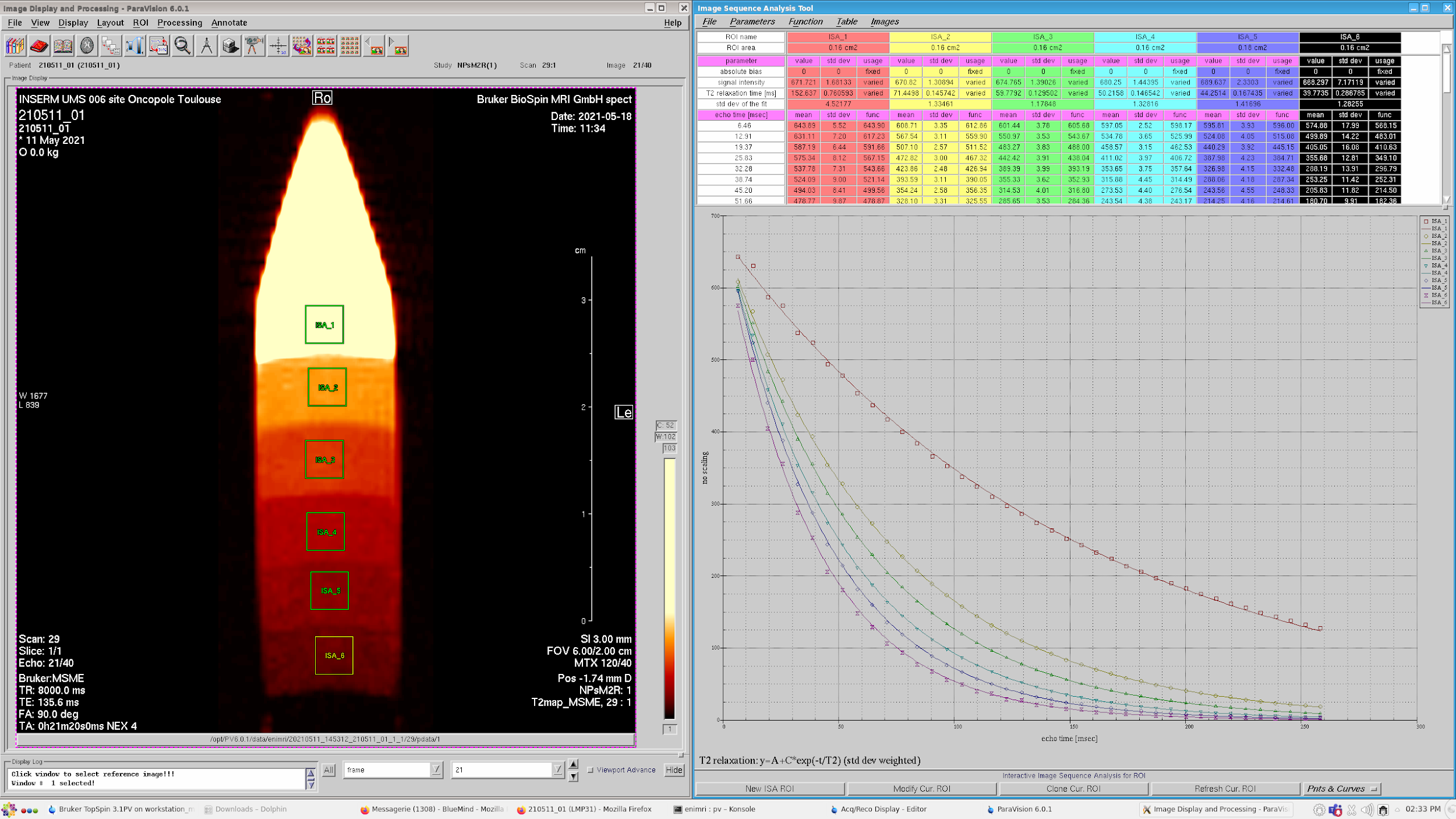
Détermination des paramètres r2 et r1 de nouvelles nanoparticules à différentes températures
Diffusion, ADC, DTI
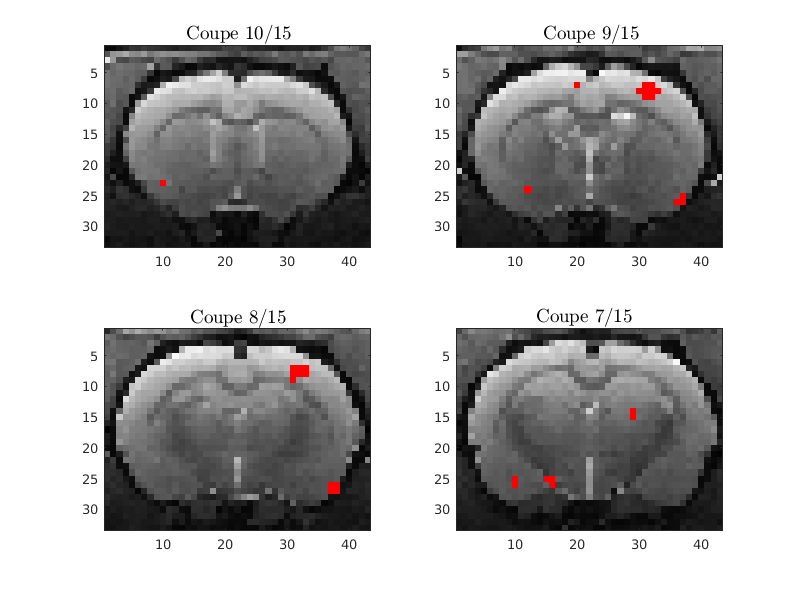
Utilisation de l’effet BOLD
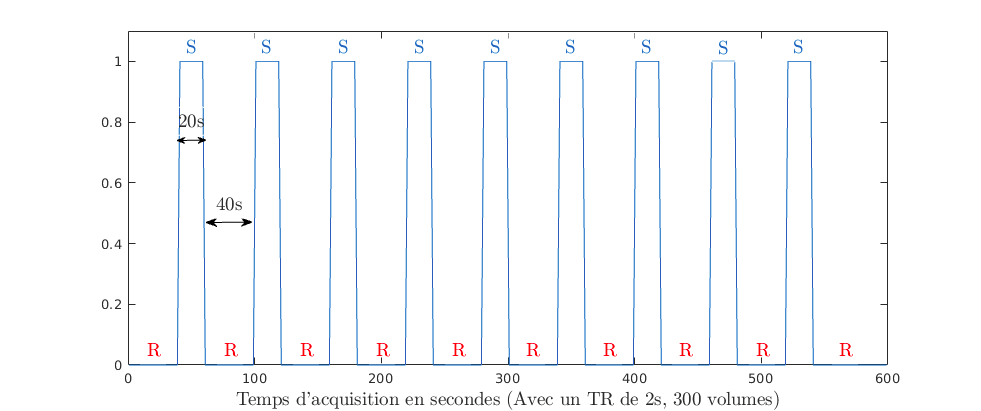
Chez le rat stimulation de la patte arrière (gauche)
Paradigme
Résultat (visualisation activité corticale droite)
Spectroscopie localisée
du 1H
Analyse du tissu cérébral :
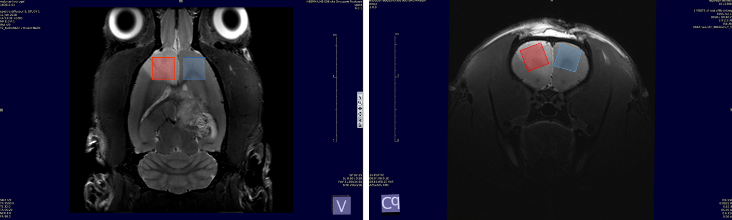
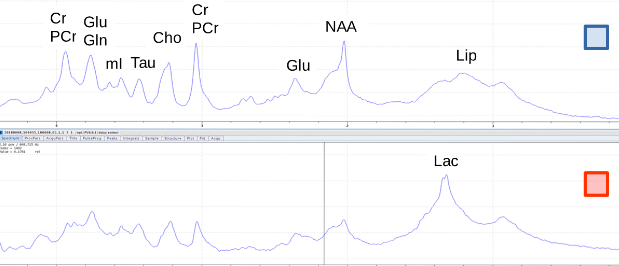
Images T2-W horizontale et axiale tête de rat, volume sélectionné (rouge avec lésion speudoischémique , bleu : contrôle). Spectres obtenus pour ces 2 volumes 6mm3 (montée du Lactate dans le tissu lésé).
Analyse du tissu adipeux : détermination du degré d’insaturation et de la longueur moyenne des chaines acyles des triglycérides à partir des spectres du tissu adipeux.
Localisation d’un volume de 1 mm3 dans le tissu adipeux en image T2-W (avec suppression du signal des triglycérides à gauche et sans suppression à droite.
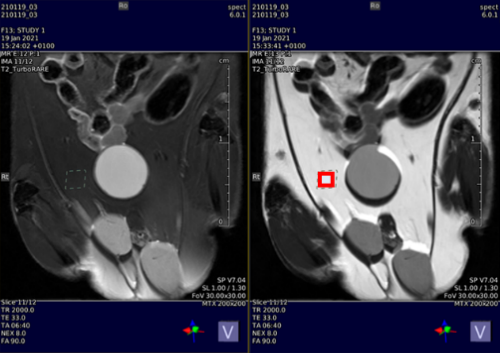
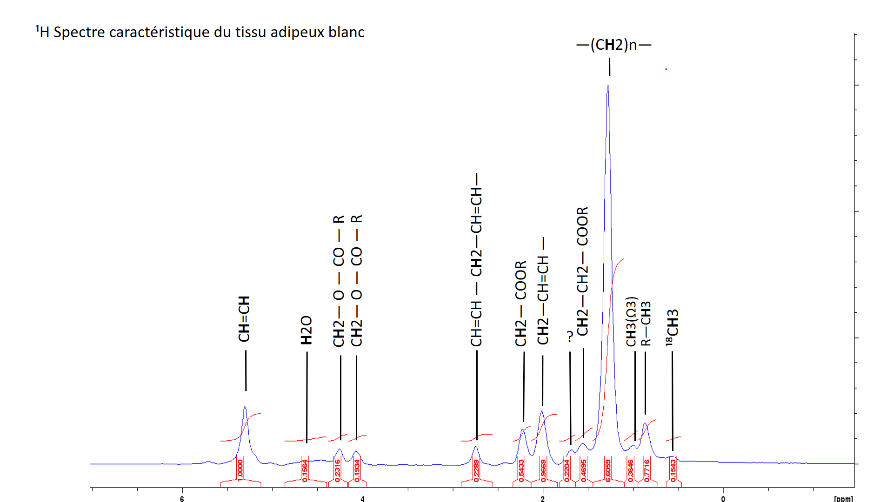
Spectre obtenu sur le volume localisé (carré rouge) permettant la caractérisation globale des triglycérides présents dans le tissu adipeux.
La transposition d’une de ces méthodes à un autre modèle implique une évaluation et une mise au point préalable.

Comment pouvons nous
vous aider ?
Vous souhaitez nous soumettre un projet, poser des questions sur les protocoles, contactez-nous et nous vous aiderons à définir au mieux les objectifs, étudier sa faisabilité technique, établir le cahier des charges, rédiger une demande d’autorisation et vous proposer une étude tarifaire sur-mesure. Votre projet sera mis en œuvre après validation administrative, technique et éthique.
